設備(装置)の再バリデーションの時期(タイミング)の考え方 ~ 第643号 ~
設備(装置)の再バリデーションはいつやるの?
> 先日、お客様より「再バリデーション」の時期(タイミング)をどのように考えたらよいか?とのご相談をいただきました。
■ そこで、今回は「設備(装置)」の再バリデーションの時期(タイミング)について考えてみたいと思います。

まずは、規格の要求から確認してみたいと思います。
規格の「再バリデーション」の定義
> 「GMP省令」では「再バリデーション」は以下のように定義されています。
■ GMP省令
④ 再バリデーション
設備、装置若しくはシステム、製造工程、洗浄作業又は試験検査の方法が、据付時に検証され、管理された状態を維持している旨を再確認するため、定期的に適格性評価、プロセスバリデーション又は洗浄バリデーションを行う。
再バリデーションを行う必要性、時期(タイミング)及び項目については、その設備、装置若しくはシステム、製造工程、洗浄作業又は試験検査に係る製品の製造頻度のほか、医薬品に係る製品にあってはGMP省令第11条の2第1項第4号及び第21条の2第1項第4号の規定による安定性モタリングの評価、同令第11条の3第1項第1の定による製品品質の照査等の結果を踏まえ、製造業者等が定めるものであること。なお、例えば、無菌性保証のための培地充填試験のように、製品品質に大きな影響を及ぼす設備、装置若しくはシステム、製造工程、洗浄作業又は試験検査方法について検証する再バリデーションは、製品品質の照査等の結果によらず、定期的に行うことが求められる。
医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の一部改正について(薬生監麻発0428第2号令和3年4月28日)
このように「時期(タイミング)」について具体的に書かれていないことがわかります。そこが悩みところではないでしょうか?
また、定義の中で「定期的」に行うとありますが、その「定期的」っていつなんでしょうか?
設備(装置)の再バリデーションの時期(タイミング)の考え方(一例)
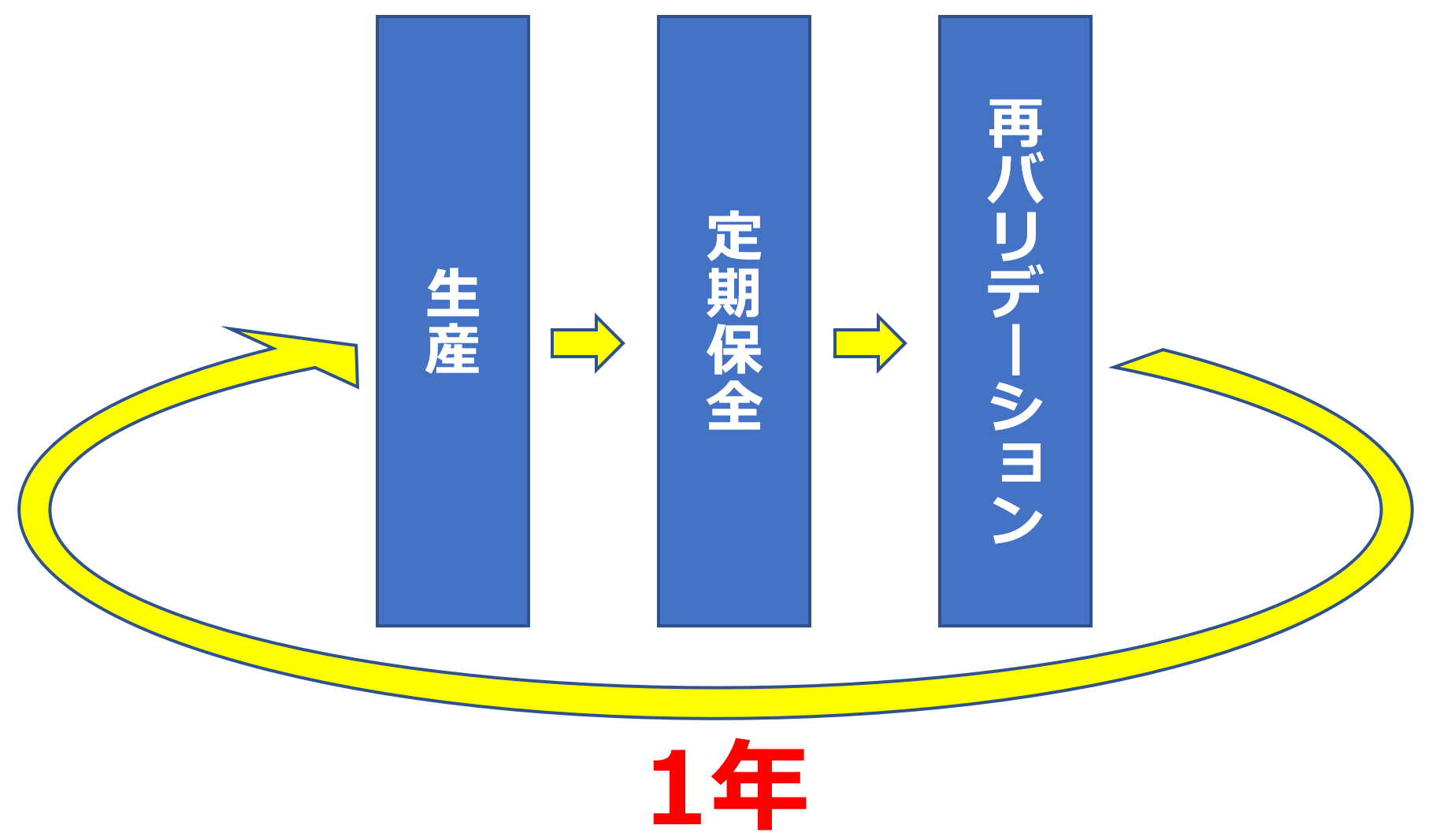
> 再バリデーションは設備(装置)の「定期保全」時に実施するのがお勧めです。
■ 医薬品は、品質、有効性および安全性を確保しながら安定供給するためには、製造の設備(装置)の定期的な保全(定期保全)が必要不可欠です。
その「定期保全」では、調整や脱着、機器交換など、設備(装置)の変化を伴うため「定期保全」後は、バリデートされた状態でなくなることを意味すると考えます。
※ よって、設備(装置)をバリデートされた状態にするためには「再バリデーション」が必要になると考えます。
再バリデーションは1年に1回の実施が最適
> この「定期保全」は一般的に1年に1回実施されることが多く、実際に当社のお客様のほとんどが1年に1回の「定期保全」を実施しています。
よって、1年に1回の再バリデーションを実施することが良いと考えられます。
※ バリデーションと言うと設備(装置)の導入時に実施するイメージの方が強いかもしれませんが、品質や安全性の観点からも「バリデートされた状態でなくなるタイミング」で再バリデーションする意識も大切です。
⇒ ここでは設備(装置)の視点で一つの考え方を示しました。
▼ 「再バリデーション」についても「無料オンライン相談会」からご相談していただくこともできます。
※ 当社は、フィールドでバリデーション・キャリブレーションを実施する立場から、規格の要求内容や定義を具体化(具現化)して、お客様に満足して頂ける作業をお届けする努力を続けています。
最後まで、お読みいただき有難うございました。

