第560号 PIC/S GMP ガイドラインとバリデーション基準の「性能適格性評価(PQ)」を比較しました
「性能適格性評価(PQ)」でのPIC/S GMP ガイドラインとバリデーション基準の要求の違い
> 今回も、PIC/S GMP ガイドラインとバリデーション基準の設備などの適格性評価について比較して実作業での違いなどを調べてみました。
比較で引用した資料は前回と同様です
□ PIC/S GMP ガイドラインは、平成27年7月8日事務連絡「PIC/SのGMPガイドラインを活用する際の考え方について」の一部改訂についてで発布されたアネックス15のクオリフィケーション及びバリデーションを引用しました。
□ バリデーション基準は、平成25年8月30日のGMP省令から引用しました。
※ 今回はPerformance qualification (PQ) :性能適格性評価」を比較してご紹介します。
PIC/S GMP ガイドラインにはバリデーション基準に該当しない要求がある
【PIC/S GMP ガイドラインとバリデーション基準との比較】
■ Performance qualification (PQ) :性能適格性評価
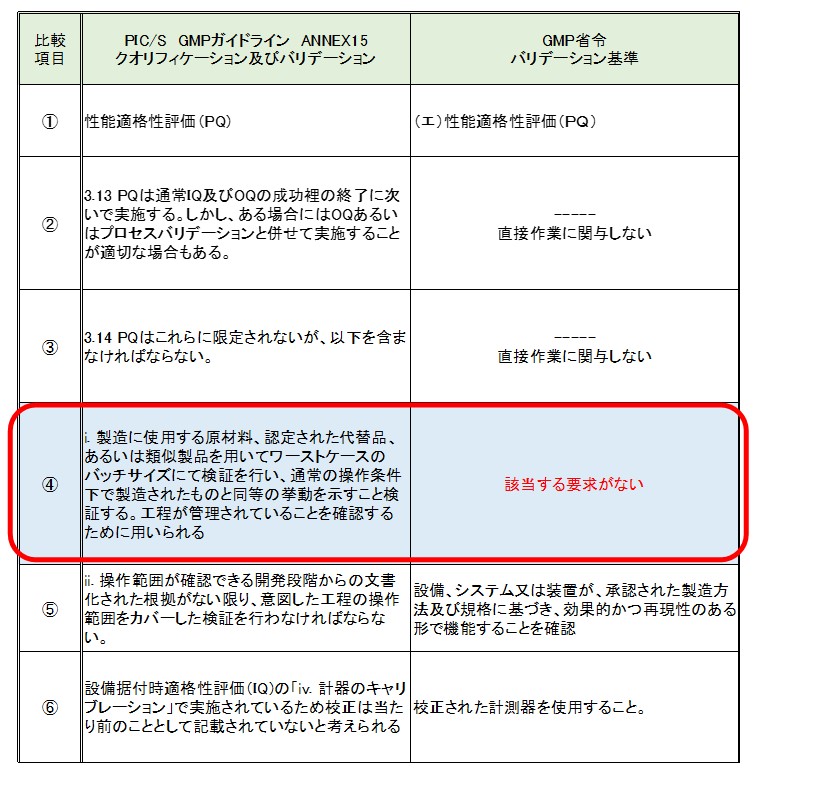
※ このように赤枠以外は、バリデーション基準とPIC/S GMP ガイドラインの要求は言葉の違いはあるものの言いたいことは同じであると考えます。
PIC/S GMP ガイドラインはリスクベースアプローチを重要視!
> 今回の比較では、バリデーション基準はPIC/S GMP ガイドラインとのギャップを埋めたと言われるが比較項目④のバリデーション基準に該当する要求を考え出すことができませんでした。
それは、「ワーストケースのバッチサイズにて検証を行い」というPIC/S GMP ガイドラインの要求は「承認された製造方法及び規格に基づき」というバリデーションの要求内容と大きな隔たりがあると考えられるからです。
■ 比較項目④は、PIC/S GMP ガイドラインパート1第1章品質マネジメント原則に記載されている以下の内容が大きく影響していると思われます。

※ ご存知のように、バリデーション基準を定める医薬品及び医薬部外品の製造管理及び品質管理の基準でも同様な要求があるのですが、PQの要求内容にこれほどの差が出るのは驚かされます。
ですが、バリデーション基準においても、バリデーション基準⑤の要求を深読みするとワーストケースの検証を実施する必要があるとも考えられます。
バリデーション基準でも、PIC/S GMP ガイドラインのワーストケースでの検証が必要と考えます
> 今回の比較した結果からは、PIC/S GMP ガイドラインでの現場の実作業ではバリデーション基準の要求からは想定しずらい内容の作業があると読み解くことが出来ます。
「PQ」においても、実際に実施する時には、両方の規格要求を参考にして、目標とする規格要求を実現することが大事だと考えられます。
■ 今回のケースでは、バリデーション基準の規格要求で適格性評価を行うとしても、PIC/S GMP ガイドラインのワーストケースの検証を考慮した方が良いと思います。
∇次回は、計画書について比較して、実作業での違いなどをご紹介したいと考えています。
※ 当社は、フィールドでバリデーション・キャリブレーションを実施する立場から、規格の要求内容や定義を具体化(具現化)して、お客様に満足して頂ける作業をお届けする努力を続けています。
最後まで、お読みいただき有難うございました。
